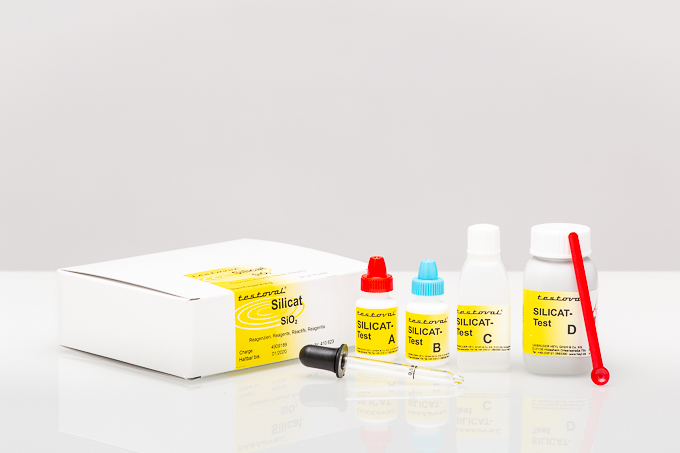
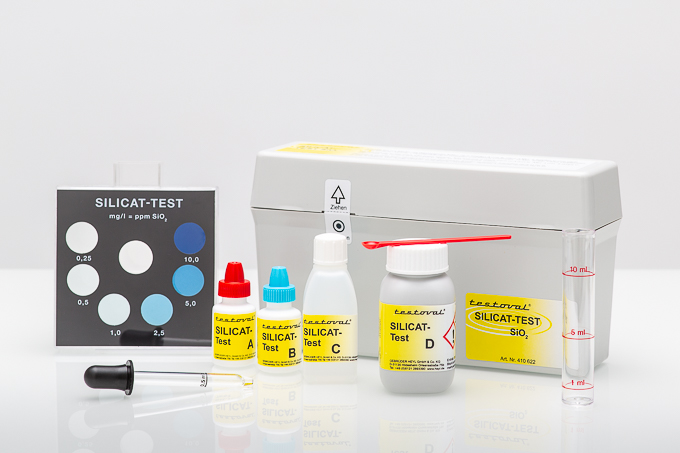
Silikat ist der Oberbegriff für anorganische SiO2 Verbindungen. Silikate sind die Salze und Ester der Ortho-Kieselsäure (Si(OH)4) und deren Kondensate. Alle Salze sind durch SiO4-Tetraeder aufgebaute Verbindungen, deren Tetraeder jedoch auf verschiedene Weise miteinander verknüpft sein können. Ein SiO4-Tetraeder ist somit der Baustein, der allen Silikaten zugrunde liegt. Ein Atom des Siliciums (SiO2) ist somit von vier Atomen Sauerstoff (O2) umgeben.
Silikate lassen sich in Wasser und weiteren Lösungsmitteln nicht auflösen.
Silikate kommen in natürlicher Form in der Erde vor. Der Mantel der Erde besteht fast zu 100% und die Kruste der Erde zu mehr als 90% aus Silikaten. Die bekannteste Silikatform ist der Quarz (SiO2). Silikate nehmen Feuchtigkeit zuverlässig auf und sind absolut geruchsneutral.
- Water Analyzers
-
Liquid chemistry
- Indicators / Reagents
- pH / ORP Buffer and Conductivity Calibration Solutions
-
Test Kits
- Product Group
-
Parameters
- Water Hardness (Ca2+ und Mg2+)
- Carbonate hardness (KH)
- m-value (total alkalinity - acid capacity up to pH 4.3, KS 4.3)
- p-value (acid capacity up to pH 8.2, KS 8.2)
- Base capacity (KB82 - to pH 8.2)
- Aluminium (Al)
- Ammonia (NH4+)
- Chlorine (Cl DPD methode)
- Chloride (Cl-)
- Chromate Cr(VI)
- Iron (II + III dissolved- Fe3O4)
- Hydrazine (N2H4)
- Carbon dioxide (CO2)
- Copper (Cu)
- Cooling lubricants (KSS)
- Nitrite (NO2)
- pH
- Phosphate (P2O5 - Ortho-Phosphate)
- Polyamines (PA - circuit water)
- Silicate (SiO2 - dissolved)
- Sulphate (SO4)
- Sulphite (SO32)
- Analysis Cases and Analysis Cabinets
- Multiparameter Handheld Photometer
- Silver resin
- Accessories
- Controls
- Electrodes and sensors
- Hand-held measuring instruments and analysis cases
- NeoTec World
- Clinical Solutions
- Blog
- Seminars & Webinars
- Ozone and UV technology
- Dosing pumps
- Gas Measuring Instruments
- Hygiene and Disinfection
- Water Meters
- Accessories
Filter products